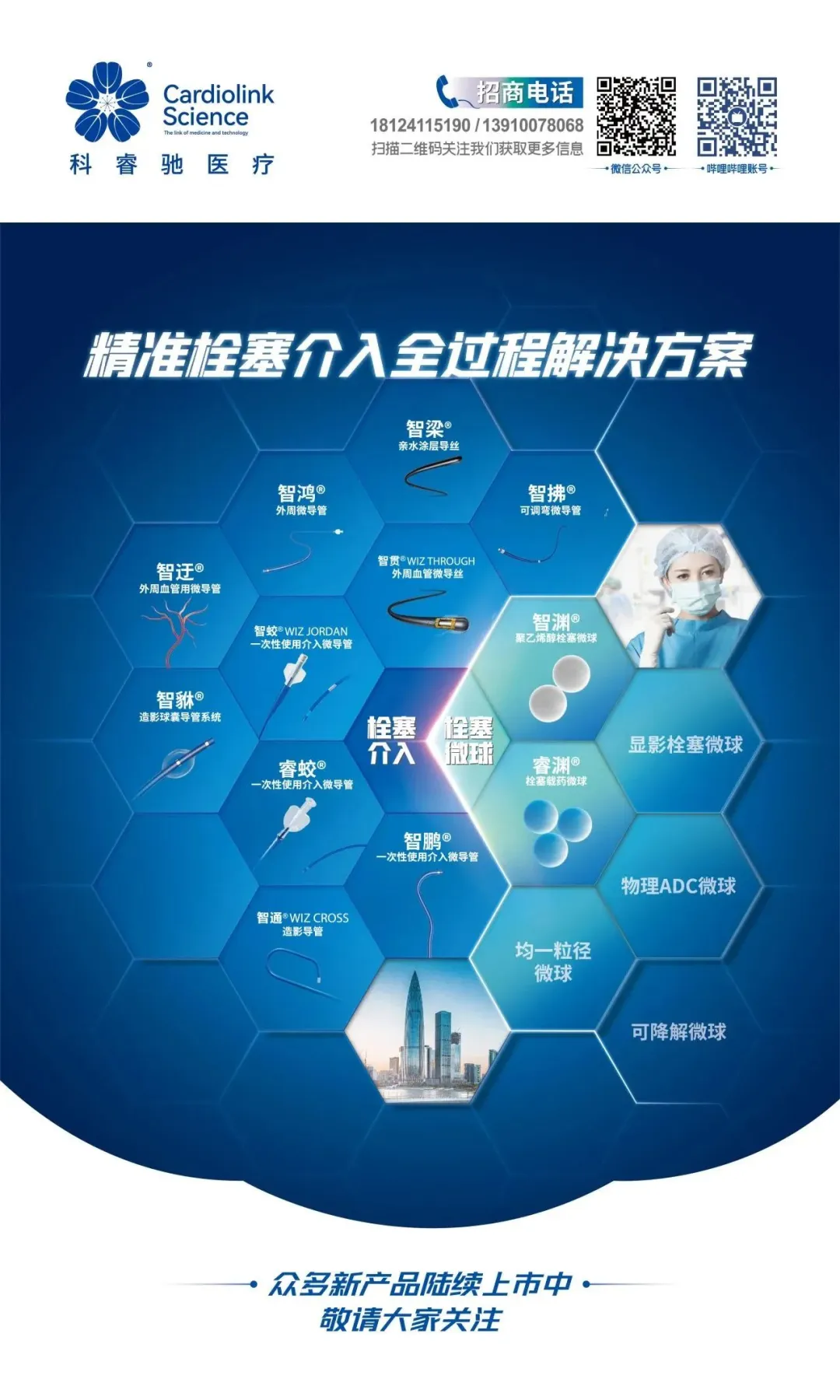
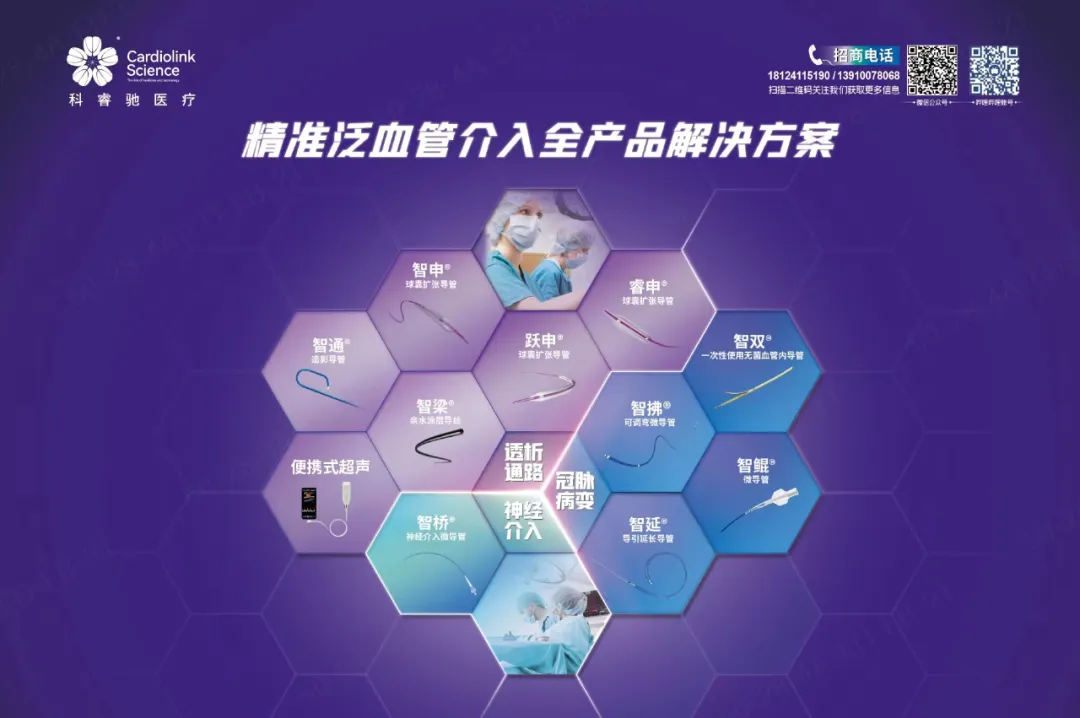
近日, 科睿驰医疗喜事连连。
科睿驰介入微导管套装产品顺利通过巴西ANVISA注册批准,且本次注册申请零发补。这也是科睿驰自主研发、自主知识产权和自主品牌的首个海外医疗器械注册获批,为科睿驰医疗TACE全过程解决方案正式进入海外市场开辟了新的战场!
同时,经国际权威检测认证机构TÜV南德的严格审查,公司顺利通过ISO13485:2016国际质量体系认证审核,并获得证书。标志着科睿驰医疗质量管理体系已达到国际标准,具备向全球医疗领域客户提供产品和技术服务的实力,为公司未来发展奠定了坚实基础。
1.巴西ANVISA注册批准
巴西作为南美洲最大的医疗器械市场,人口规模2亿多,2021年全年GDP增长4.6%,国内生产总值1.61万亿美元,人均国内生产总值7518美元。
巴西国家卫生监管机构 (ANVISA)是巴西联邦政府卫生部属下的卫生监管机构,负责批准医疗器械的销售和使用许可。只有经过注册之后的医疗器械才被允许在巴西销售和使用。
微导管套装产品在巴西获批,是科睿驰扬帆出海的重大里程碑。不仅丰富了公司的产品线,将市场触角延伸至更大的广度,显著提升了科睿驰的国际品牌影响力和市场地位,为商业化拓展提供了新动能。
2.ISO13485:2016国际质量体系认证

ISO13485体系是国际标准化组织(ISO)所制定的医疗器械质量管理体系标准,该体系是在ISO9001标准的基础上,增加了医疗器械行业的特殊要求,重点针对与医疗器械设计开发、生产、贮存和流通、安装、服务和最终停用及处置等相关行业的组织,旨在规范医疗器械制造商、供应商及相关服务商的质量管理流程,确保产品符合行业法规和顾客要求。
认证机构对公司从质量管理体系、管理职责、资源管理、产品实现以及测量、分析和改进等方面进行了全面严格的审核。最终,审核组给予高度评价,公司的质量管理体系整体运行良好,各项工作满足规范要求。
本次ISO13485:2016国际质量体系认证通过+巴西ANVISA注册许可获批,极大地增强了科睿驰医疗进军海外市场的信心与决心。
科睿驰医疗也将一如既往秉承“基于疗法阅读,重构局部免疫生态,构建细胞贯序凋亡、死亡的靶向治疗器械与药物递送系统”的理念,将临床需求与工程技术零衔接,为术者应对临床挑战提供智慧化工具,帮助更多国内患者缓解病痛,延长生命的同时,进一步积极开拓海外市场,助力全球医疗健康领域的创新发展,为推动构建人类命运共同体作出更大贡献。